Infiammazione cronica
e tumori
L'infiammazione cronica di basso grado può contribuire sia alla comparsa sia alla progressione dei tumori. Oltre il 20% di tutte le neoplasie è indotto o aggravato da un processo infiammatorio; esempio tipico è quello del tumore dello stomaco, che è associato alla gastrite, l'infiammazione della parete dello stomaco. Anche il carcinoma epatocellulare (il principale tumore maligno del fegato) è associato all'infiammazione cronica, mentre la colite (cioè l'infiammazione del colon) è associata al cancro del colon; viceversa, l'assunzione di farmaci antinfiammatori non steroidei (i Fans) è stata associata a una riduzione dell'incidenza di questo tumore variabile tra il 30 e il 60%.
Studi su modelli animali suggeriscono il coinvolgimento di fenomeni infiammatori anche nella comparsa di altre forme tumorali. Ricerche condotte sui topi suggeriscono per esempio che la mutazione nell'oncogene K-Ras porti allo sviluppo dell'adenocarcinoma pancreatico solo in presenza di una pancreatite cronica. Le infezioni non solo le uniche possibili cause alla base di questi fenomeni infiammatori: anche le variazioni ormonali, il fumo di sigaretta e altre sostanze tossiche, a loro volta sorgenti di infiammazione cronica, aumentano il rischio di tumore. Si stima, per esempio, che quasi il 20% dei fumatori alle prese con una bronchite (un'infiammazione dei bronchi) possa sviluppare un cancro.
Infine, lo sviluppo dei tumori è stato associato anche alla presenza di specifiche varianti di geni dall'attività infiammatoria (come quelli codificanti per il Tumor Necrosis Factor o per l'interleuchina 1) e di mutazioni in geni chiave per l'immunità innata.
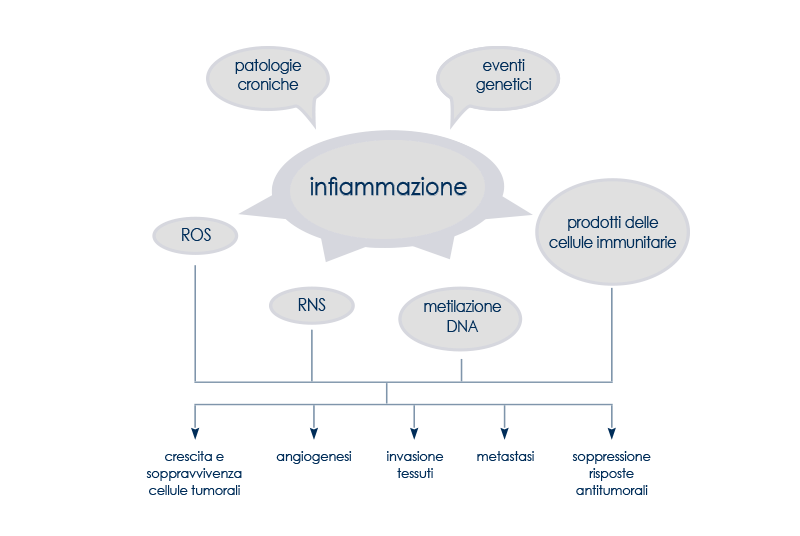
Esiste più di un meccanismo attraverso cui l'infiammazione può contribuire alla comparsa o alla proliferazione di un tumore; può per esempio indurre mutazioni in geni importanti per il controllo della sopravvivenza, della moltiplicazione o dell'invecchiamento delle cellule, oppure può renderle resistenti all'azione del sistema immunitario o a segnali che ne limiterebbero la crescita. Agendo attraverso vie estrinseche (condizioni croniche associate a infiammazione di basso grado) e vie intrinseche (eventi genetici che regolano la comparsa dell'infiammazione associata al cancro), gioca un ruolo fondamentale in diversi aspetti dello sviluppo del tumore, dalla trasformazione delle cellule in senso tumorale all'angiogenesi, passando per le capacità delle cellule di sopravvivere, di proliferare, di invadere i tessuti e di formare delle metastasi. Per di più l'infiammazione cronica è associata anche all'immunosoppressione, noto fattore di rischio per lo sviluppo di tumori.
I mediatori della sua azione sono molteplici: dalle specie reattive dell'ossigeno e dell'azoto (rispettivamente ROS e RNS, molecole in grado di promuovere lo sviluppo dei tumori danneggiando non solo il DNA ma anche le proteine e i lipidi) alla metilazione del DNA (un meccanismo in grado di regolare l'espressione dei geni senza modificarne la sequenza), passando per una serie di molecole prodotte dalle cellule del sistema immunitario presenti nel microambiente in cui si sviluppa un tumore. Queste molecole possono promuovere la crescita e la sopravvivenza delle cellule tumorali, l'angiogenesi, l'invasione dei tessuti e la formazione di metastasi, oppure possono sopprimere le risposte immunitarie antitumorali.
Infiammazione, ROS, RSN e tumori
L'infiammazione cronica è associata alla produzione di specie reattive dell'ossigeno(ROS) e dell'azoto (RSN) sia da parte delle cellule dell'infiammazione – in cui è attivata da fattori come la presenza di agenti infettivi, fisico-chimici o endogeni – sia da parte delle cellule epiteliali. Queste molecole, estremamente reattive, promuovono lo sviluppo dei tumori danneggiando il DNA, le proteine e i lipidi.
| AGENTE | DANNO |
|---|---|
| perossinitrito derivante dalla reazione fra ossido nitrico (NO) e superossido | formazione di 8-oxo-7,8-diidro-2'-deossiguanosina (8-oxodG) e 8-nitroguanina |
| radicale ossidrile derivante dalla reazione tra perossido di idrogeno e ferro | carbonilazione irreversibile di DNA e proteine |
Le conseguenti lesioni alterano il funzionamento delle molecole colpite, danneggiano i tessuti e attivano le cellule staminali per la rigenerazione dei tessuti danneggiati. Tuttavia, ROS e RSN possono danneggiare anche le cellule staminali, portando all'accumulo di mutazioni e alla possibile comparsa di cellule staminali tumorali associate allo sviluppo di forme tumorali particolarmente aggressive.
Quello che si può instaurare è un vero e proprio circolo vizioso di infiammazione e stress ossidativo che gioca un ruolo cruciale nello sviluppo dei tumori.
Infiammazione, metilazione del DNA
e tumori
Per “metilazione del DNA” si intende l'aggiunta di un gruppo chimico detto metile a specifiche sequenze di DNA. Fra queste sono inclusi i siti CpG presenti all'interno di promotori dei geni codificanti per oncosoppressori e per micro-RNA a loro volta in grado di sopprimere i tumori.
Le specie reattive dell'ossigeno (ROS) e dell'azoto (RSN) prodotte in presenza di infiammazione cronica inducono una demetilazione generalizzata del DNA, portando a un fenomeno associato allo sviluppo del cancro: l'instabilità genomica. I fattori associati all'infiammazione che possono influenzare la metilazione del DNA sono però anche altri, in particolare le citochine proinfiammatorie.
In un microambiente proinfiammatorio queste molecole (per esempio l'interleuchina 6) influenzano la trascrizione del gene per la DNA metiltranferasi 1 (DNMT1), proteina coinvolta proprio nella metilazione del DNA. Il conseguente aumento della metilazione dei siti CpG riduce l'espressione di geni e microRNA oncosoppressori, evento che può rappresentare il primo passaggio della carcinogenesi.