I marcatori biomolecolari dell'infiammazione nei tumori
Diversi marcatori biomolecolari dell'infiammazione sono associati anche ai tumori. Fra i più noti è inclusa la proteina C reattiva (PCR), molecola la cui produzione è regolata dalle citochine proinfiammatorie. I livelli di PCR sono molto bassi nelle persone sane, ma aumentano rapidamente con l'infiammazione e sono associati alla progressione del tumore e alla riduzione della sopravvivenza in presenza di diverse neoplasie – per esempio all'esofago, allo stomaco, del colon-retto, del fegato, del pancreas e dell'ovaio.
In generale, concentrazioni di PCR più elevate sono associate a un maggior rischio di sviluppare un cancro. I livelli prediagnostici di PCR sono per esempio associati all'incidenza del tumore del colon-retto e al rischio di cancro al seno. Non solo, nel caso del tumore del colon-retto le concentrazioni di PCR prima della diagnosi correlano anche con la mortalità dovuta al cancro.
Per quanto riguarda invece le citochine, a offrire un esempio del loro coinvolgimento è il caso del tumore al seno. A produrle possono essere sia le cellule dell'infiammazione, sia le cellule del tumore e quelle presenti nell'ambiente circostante. Livelli elevati di interleuchina 1β (IL-1β) sono associati a patologie più avanzate, e livelli elevati di interleuchina 6 (IL-6) sembrano contribuire alla progressione della malattia. In generale, la produzione di citochine proinfiammatorie come il Tumor Necrosis Factor α TNF-α) da parte di macrofagi associati al tumore (Tumor-Associated Macrophages, TAMs) può contribuire alla loro capacità di promuovere lo sviluppo dei tumori. Proprio le concentrazioni ematiche di TNF-α sono state associate a tumori in stadio più avanzato.
In effetti fra le diverse citochine, il TNF è un fattore particolarmente importante nella promozione dello sviluppo di diversi tipi di tumori. Prodotto nella fase iniziale della risposta infiammatoria, gioca un ruolo fondamentale nel mantenimento dell'infiammazione cronica ed è coinvolto nella crescita dei tumori, nell'angiogenesi, nel rimodellamento dei tessuti e nella formazione delle metastasi.
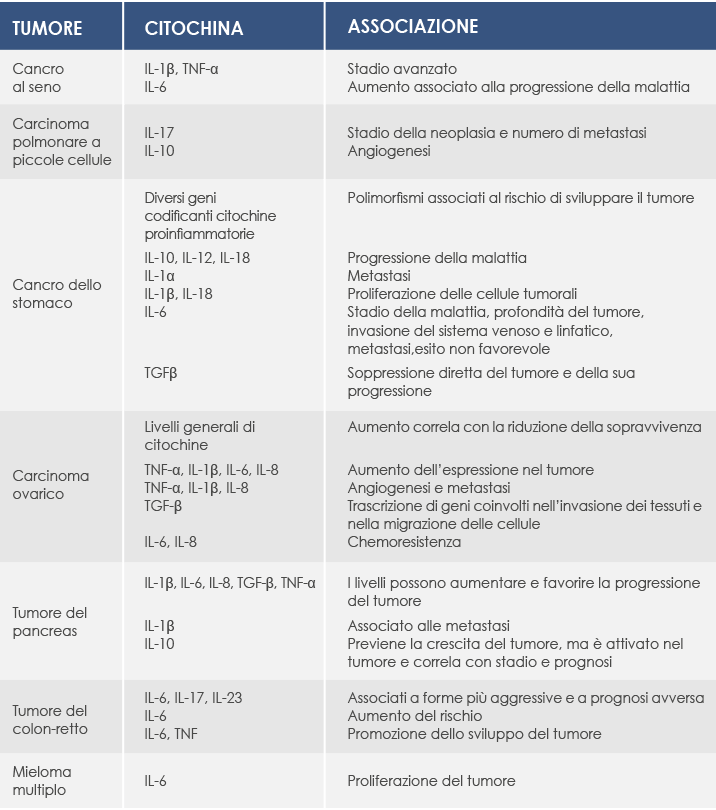
In presenza di queste ultime aumenta anche l'interleuchina 17 (IL-17). Insieme a quella di interleuchina 23 (IL-23), l'espressione di IL-17 è stata rilevata in tumori del colon, delle ovaie, dei polmoni, del seno, dello stomaco, della pelle, del fegato e della testa e del collo. Nel caso del tumore del polmone a piccole cellule è stata associata anche allo stadio della neoplasia e al numero delle metastasi; per questo si ritiene che possa rappresentare un nuovo marcatore prognostico.
Un altro potente induttore dell'angiogenesi nel carcinoma polmonare a piccole cellule è l'interleuchina 10 (IL-10), che nel caso del tumore allo stomaco sembra invece contribuire alla progressione della malattia sopprimendo l'immunità antitumorale. Sempre nel tumore allo stomaco, un effetto simile a quello dell'IL-10 potrebbe essere attribuito all'interleuchina 12 (IL-12) e all'interleuchina 18 (IL-18), mentre l'interleuchina 1α (IL-1α) correla con le metastasi, l'IL-1β e l'IL-18 stimolano la proliferazione delle cellule tumorali e l'IL-6 è associata allo stadio della malattia, alla profondità del tumore, all'invasione del sistema linfatico e del sistema venoso, alle metastasi e a un esito non favorevole. Infine, il Transforming Growth Factor β (TGFβ) sembra giocare un complesso ruolo nella soppressione diretta del tumore e della sua progressione (probabilmente per le sue proprietà immunosoppressive e antinfiammatorie) che potrebbe dipendere dallo stadio della malattia e dal tipo di cellule coinvolte.
I marcatori biomolecolari dell'infiammazione nei tumori
L'infiammazione cronica di basso grado non è associata dai classici sintomi dell'infiammazione acuta (gonfiore, dolore, arrossamento e calore), ma fortunatamente oggi numerosi marcatori biomolecolari permettono di riconoscere la sua presenza grazie ad una semplice analisi del sangue. Fra di essi sono incluse diverse citochine – mediatori dei processi infiammatori, come il TNF-α, le interleuchine 1, 6 e 12 e l'interferone – e la proteina C reattiva (PCR), una proteina prodotta dal fegato proprio in risposta alla presenza di citochine proinfiammatorie.
Le citochine proinfiammatorie
Prodotte dalle cellule dell'infiammazione attivate, le citochine proinfiammatorie sono regolate da diversi meccanismi. Fra i più importanti c'è l'attività di SOCS (Suppressor Of Cytokine Signaling), una proteina che promuove un'ulteriore attivazione delle cellule dell'infiammazione agendo su fattori di trascrizione come NF-kB (un regolatore fondamentale dei processi infiammatori) e STAT (Signal Transducers and Activators of Transcription) 1 e 3.
Quando viene attivato da stimoli proinfiammatori NF-kB porta all'espressione coordinata di più geni dall'azione proinfiammatoria o associata all'immunità innata, fra cui IL-1, 4 e 6 e TNF-α. Molti di questi geni vengono attivati anche dagli stimoli proinfiammatori che agiscono su STAT1 (che è fondamentale per l'azione dell'IFN-γ e promuove la morte cellulare programmata indotta da NF-kB) e STAT3 (che invece, attivato IL-10, promuove la proliferazione cellulare sopprimendo l'attività di NF-kB).
Il Granulocyte-Macrophage
Colony-Stimulating Factor (GM-CSF)
Il Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) è una citochina in grado di stimolare la produzione di cellule del sangue nel midollo osseo, fra cui i globuli bianchi appartenenti alle classi dei granulociti e dei macrofagi. Rispetto ad altri membri della superfamiglia del CSF, però, il suo ruolo di supporto a queste cellule è marginale, soprattutto se paragonato a quello di mediatore dell'infiammazione.
La sua espressione è associata a diversi fenomeni di natura infiammatoria. È, per esempio, attivato nel liquido cerebrospinale dei pazienti con sclerosi multipla; inoltre è attivato anche in tessuti infiammati come quelli della pelle colpita da reazioni cutanee e quelli delle articolazioni colpite dall'artrite reumatoide, e aumenta rapidamente e significativamente in risposta al lipopolisaccaride (LPS), tossina di origine batterica.
A produrlo sono diversi tipi di cellule. Classicamente, quello che viene associato alle malattie infiammatorie croniche a base autoimmune come l'artrite reumatoide è sintetizzato dai linfociti T in seguito alla stimolazione da parte di una o più interleuchine (IL-2, IL-7, o una combinazione di IL-1 e IL-23). Tuttavia, nella sclerosi multipla viene prodotto anche dai linfociti B.
Il danno tissutale associato all'infiammazione cronica promossa dal GM-CSF non è però causato direttamente dai linfociti. Piuttosto, sarebbe la capacità di questa citochina di mettere in connessione i linfociti T e cellule come i macrofagi e i granulociti a scatenare effetti che in caso di infiammazione cronica possono finire per danneggiare tessuti altrimenti sani, per esempio la produzione di specie reattive dell'ossigeno.
Riportare nella norma livelli di GM-CSF elevati potrebbe aiutare a combattere l'infiammazione cronica. Questo approccio si è già dimostrato potenzialmente efficace in presenza di una diagnosi di artrite reumatoide. Sperimentazioni effettuate in presenza di sclerosi multipla hanno dimostrato l'assenza di effetti collaterali inattesi in caso di sclerosi multipla.
Il Tumor Necrosis Factor α (TNF-α) è una citochina proinfiammatoria fondamentale nel mantenimento dell'infiammazione sistemica di basso grado. Il suo ruolo è indispensabile in presenza, per esempio, di traumi o infezioni; tuttavia, quando i suoi livelli si mantengono costantemente alti si instaura uno stato di infiammazione cronica che può danneggiare i tessuti. In particolare, il TNF-α può contribuire al malfunzionamento dei vasi sanguigni e allo sviluppo di ipertensione e aterosclerosi.
In individui apparentemente sani è associato alla pressione sanguigna: un aumento costante nella sua produzione, seppur a bassi livelli, favorisce la vasocostrizione inducendo, di conseguenza, l'ipertensione. In particolare, questa citochina compromette il processo di vasodilatazione che dipende dall'endotelio (l'epitelio di rivestimento interno dei vasi sanguigni) riducendo la biodisponibilità del principale mediatore di questo fenomeno, l'ossido nitrico (NO), di cui abbassa la produzione e, allo stesso tempo, aumenta lo smaltimento.
Ma non solo: il TNF-α media la resistenza all'insulina a livello dei vasi sanguigni, contribuendo alla disfunzione generalizzata dell'endotelio sia nel diabete sia nella sindrome cardiometabolica. Inoltre regola la pressione anche a livello dei reni e del muscolo cardiaco.
Sempre a livello dei vasi sanguigni, il TNF-α stimola anche la produzione di specie reattive dell'ossigeno e induce l'espressione di molecole di adesione che mediano il reclutamento e la migrazione delle cellule dell'infiammazione all'interno della parete dei vasi sanguigni, favorendo così il processo di aterosclerosi. Allo stesso tempo, induce l'instaurarsi di condizioni proaterogene favorendo la proliferazione e la migrazione delle cellule muscolari lisce associate all'endotelio.
Infine, riduce la contrattilità delle cellule muscolari cardiache, induce la loro ipertrofia e, in vitro, ne promuove la morte programmata.
L'interleuchina 6 (IL-6) è una citochina in grado di stimolare l'infiammazione acuta associata alle infezioni e ai danni ai tessuti. La sua produzione agisce come un segnale di allarme e di difesa; tuttavia, quando la sua attività si mantiene costantemente elevata la risposta infiammatoria diventa di tipo cronico, con i possibili pericoli che ne conseguono. Non solo, una produzione continua di IL-6 è coinvolta nei fenomeni di autoimmunità.
Dopo essere stata prodotta l'IL-6 si sposta attraverso il torrente circolatorio nel fegato, dove vengono rapidamente prodotte diverse proteine associate alla fase acuta dell'infiammazione, come la proteina C reattiva
(PCR) e la siero amiloide A (SAA). Se la sua concentrazione rimane elevata a lungo, la SAA induce la deposizione di fibrille amiloidi, una grave complicanza di diverse malattie infiammatorie croniche che porta al progressivo deterioramento degli organi.
Inoltre l'IL-6 riduce i livelli ematici di ferro e di zinco, portando a forme di anemia e di carenza di ferro e zinco associate all'infiammazione cronica. E le conseguenze della sua attivazione non finiscono qui; fra gli altri sono inclusi:
- il rilascio di piastrine dal midollo osseo, un marcatore della gravità dell'infiammazione;
- una modulazione del differenziamento dei linfociti che porta alla compromissione della tolleranza immunologica coinvolta nello sviluppo delle malattie infiammatorie croniche e autoimmuni;
- la produzione eccessiva di immunoglobuline e la sintesi di autoanticorpi;
- il riassorbimento dell'osso e l'osteoporosi;
- l'aumento dell'angiogenesi e della permeabilità dei vasi sanguigni, due caratteristiche patologiche delle lesioni infiammatorie associate, per esempio, all'artrite reumatoide;
- la proliferazione dei cheratinociti e la produzione di collagene nei fibroblasti del derma, associata alla sclerosi sistemica.
Diverse patologie a base infiammatoria o autoimmune, così come anche varie forme tumorali, sono state associate alla produzione anomala di IL-6. Studi su modelli animali hanno dimostrato che bloccare la sua azione può prevenire o sopprimere lo sviluppo di queste malattie.
Quella dell'interleuchina (IL) 17 è una famiglia di citochine proinfiammatorie formata da 6 membri distinti. Fra di essi, l'interleuchina 17A (IL-17A) è prodotta in quantità elevate in diverse malattie di natura cronica, come l'artrite reumatoide, la sclerosi multipla, le malattie infiammatorie intestinali e la psoriasi; il suo recettore (IL-17RA) è espresso in diversi tipi di cellule e di tessuti.
Le citochine appartenenti alla famiglia dell'IL-17 possono essere prodotte da diverse cellule del sistema immunitario, ma la loro fonte principale è un tipo specifico di linfociti T, noti come Th17
I linfociti Th17 sono stimolati dall'IL-23; la conseguente produzione di IL-17 aumenta la sintesi di altre citochine e la migrazione di un altro tipo di cellule immunitarie, i neutrofili.
L'IL-17A e l'IL-17F (caratterizzata da una struttura molto simile a quella dell'IL-17A, con cui condivide gli stessi recettori) agiscono anche su altre cellule (come i macrofagi, i fibroblasti, gli osteoblasti, i condrociti e le cellule endoteliali). La loro azione porta alla sintesi di altre citochine proinfiammatorie: il Tumor Necrosis Factor α (TNF-α), l'IL-1β, l'IL-6, il Granulocyte-Macrophage Colony-Stimulating Factor (GM-CSF) e il granulocyte colony-stimulating factor (G-CSF).
I membri della famiglia dell'IL-17 giocano un ruolo fondamentale contro le infezioni da parte di batteri e funghi. Tuttavia, una loro eccessiva attività è stata associata a diverse malattie infiammatorie, come la psoriasi, l'artrite psoriasica, l'artrite reumatoide e la spondilite anchilosante. Stimolando l'espressione di enzimi in grado di degradare la cartilagine l'IL-17 contribuisce alla sua distruzione, e attivando gli osteoclasti (le cellule che demoliscono l'osso) promuove la degradazione del tessuto osseo. È stato inoltre dimostrato che i linfociti Th17 che producono IL-17A sono coinvolti anche nell'infiammazione vascolare; più in generale, le molecole infiammatorie prodotte dai linfociti Th17 favoriscono l'infiammazione cronica.
Durante questo fenomeno la stimolazione da parte dell'IL-23 aumenta la patogenicità dei linfociti Th17, portando alla produzione sia di IL-17 sia di altre citochine, come l'interferone γ (IFN-γ), l'IL-22 e il GM-CSF. Spesso quando agisce da sola l'IL-17 è poco attiva; tuttavia, può sinerigzzare con queste ed altre molecole coinvolte nei processi infiammatori, come il TNF-α e l'IL-1β portando a un aumento della produzione di altri mediatori dell'infiammazione, come l'IL-6 e l'IL-8.
L'IL-17 può per esempio stabilizzare l'espressione di mRNA attivata dal TNF-α e indurre l'espressione del recettore per questa citochina, aumentando le risposte scatenate dalla sua presenza. l'IL-17A e l'IL-17F possono anche indurre l'espressione di geni proinfiammatori in sinergia con molecole come l'IL-1, l'IL-6, il G-CSF e le metalloproteasi della matrice.
Anche nel caso dell'infiammazione vascolare l'IL-17A amplifica la risposta infiammatoria indotta da danni preesistenti, sostenendo piuttosto che inducendo l'infiammazione. Nelle cellule dell'endotelio (l'epitelio che riveste internamente i vasi sanguigni) l'azione combinata dell'IL-17A e del TNF-α induce uno stato proinfiammatorio, procoagulante e protrombotico. L'IL-17A sostiene l'iper-reattività delle piastrine, la amplifica e partecipa all'angiogenesi, fondamentale nell'infiammazione cronica e nel rimodellamento dei tessuti associati alle malattie a base autoimmune. Infine, in presenza di sindrome coronarica acuta questa citochina favorisce la funzionalità delle piastrine, e in caso di infarto acuto del miocardio è associata allo sviluppo di trombi.
Date le sue azioni, l'IL-17 è considerata un interessante bersaglio terapeutico. La sua inibizione (e quella del suo recettore) si sono dimostrate approcci efficaci nel trattamento della psoriasi, e attualmente sono diverse le molecole in via di studio che agiscono bloccando proprio i processi in cui è coinvolta l'IL-17. Sia studi preclinici sia studi in fase clinica hanno fornito solide prove della validità di approcci mirati a colpire l'IL-17 per far fronte a patologie a base infiammatoria o autoimmune.
Anche la proteina C reattiva (PCR) è considerata un marcatore dell'infiammazione. I suoi livelli basali sono piuttosto variabili da individuo a individuo, e questa variabilità interindividuale è per il 35-40% basata su fattori ereditari. Gli aumenti associati ai processi infiammatori non lasciano però spazio a dubbi, portando i suoi livelli a moltiplicarsi anche fino a mille volte; in presenza di gravi danni ai tessuti, inclusi quelli che possono essere indotti dalla progressione di un tumore, passano da circa 1 μg/ml a oltre 500 μg/ml nell'arco di sole 24-72 ore.
La PCR è prodotta principalmente dalle cellule del fegato. Lo stimolo che porta alla sua sintesi è l'aumento di citochine proinfiammatorie come l'interleuchina (IL) 6, il Tumor Necrosis Factor α (TNF-α) e l'IL-1; in particolare, l'IL-6 è necessaria, anche se non sufficiente, per indurre l'espressione della PCR. In assenza di infiammazione il reticolo endoplasmatico degli epatociti la rilascia lentamente; la sua secrezione aumenta però rapidamente in seguito all'aumento dei livelli di citochine infiammatorie.
Oltre che dagli epatociti la PCR può essere sintetizzata anche dalle cellule muscolari lisce, dalle cellule endoteliali, dai macrofagi, dai linfociti e dagli adipociti. Una volta eliminato lo stimolo infiammatorio i suoi livelli dovrebbero ridursi, diminuendo esponenzialmente in 18-20 ore.
I livelli di PCR sono da tempo utilizzati come marcatore delle infezioni e di eventi cardiovascolari. In particolare, concentrazioni seriche di PCR elevate rappresentano un forte indicatore indipendente di malattie cardiovascolari in individui altrimenti asintomatici. Inoltre sono state associate alla prognosi in caso di aterosclerosi, scompenso cardiaco congestizio, fibrillazione atriale, miocardite, problemi alla valvola aortica e trapianto cardiaco.
Ma c'è di più: l'espressione della PCR è infatti elevata anche in presenza di altri disturbi associati all'infiammazione, per esempio l'artrite reumatoide. Per di più i suoi livelli basali possono modificarsi a causa di molti altri fattori, fra cui l'età, il fumo, il peso, i livelli di lipidi nel sangue, la pressione sanguigna e l'assunzione per via orale della terapia ormonale sostitutiva. Quando ad alterarli è la presenza di una malattia, sono molto pochi i casi in cui è possibile ridurli affidandosi a farmaci che non agiscano sulla patologia sottostante.
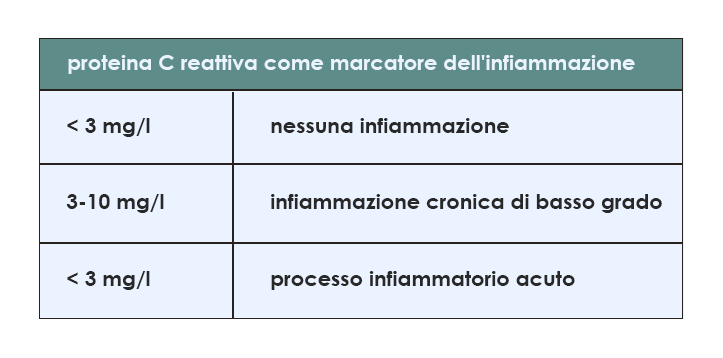
Nel caso dell'associazione con il rischio cardiovascolare, l'aumento della PCR è molto minore rispetto a quello misurabile in risposta all'infiammazione acuta; il livello soglia al di sopra del quale il rischio viene considerato significativo è fissato a 3 mg/l. Più in generale, quando sono utilizzati come indicatori della presenza di un'infiammazione cronica di basso grado i livelli di PCR sono considerati elevati se compresi tra 3 e 10 mg/l, concentrazioni presenti in una fetta non trascurabile della popolazione del mondo occidentale (per esempio, ben nel 30% degli abitanti del Nord America). Al di sopra dei 10 mg/l si sospetta invece un processo infiammatorio acuto.
La PCR non è però solo un marcatore; piuttosto, questa proteina gioca un ruolo attivo nei processi infiammatori. Alcuni dati suggeriscono per esempio che contribuisca alla risposta infiammatoria legandosi alle membrane cellulari danneggiate e interagendo con le proteine del sistema del complemento (una componente fondamentale delle difese immunitarie innate), soprattutto a livello delle lesioni aterosclerotiche. Qui induce l'espressione di geni direttamente coinvolti nel richiamo e nell'adesione delle cellule dell'immunità; inoltre è stato rilevato un suo coinvolgimento nei meccanismi attraverso cui i macrofagi inglobano le lipoproteine a bassa densità (la forma di colesterolo associata all'aumento del rischio cardiovascolare).
La PCR può anche stimolare la produzione di citochine che favoriscono la morte delle cellule mediante apoptosi (IL-1β e TNF-α) e di specie reattive dell'ossigeno. L'apoptosi può verificarsi anche all'interno delle placche aterosclerotiche, favorendone la rottura, e la PCR può indurla anche nelle cellule muscolari lisce associate alle arterie coronarie.
Infine, in esperimenti condotti in vitro la PCR ha dimostrato di ridurre significativamente l'angiogenesi, la migrazione cellulare e la formazione di strutture simili ai capillari attenuando la produzione di ossido nitrico (NO). Ed è sempre in un processo associato alla riduzione dell'ossido nitrico che la PCR promuove l'aterosclerosi attraverso la vasocostrizione, l'adesione dei globuli bianchi e l'infiammazione. Per di più, la PCR influenza anche i livelli di IL-6, IL-8 e monocyte chemoattractant protein-1 (MCP-1), una citochina coinvolta nella migrazione e nell'infiltrazione dei globuli bianchi.
L'eliminazione selettiva delle citochine
Mantenere i livelli dei mediatori dell'infiammazione al di sotto dei limiti di allerta può aiutare a ridurre i fattori di rischio associati allo sviluppo di malattie associate all'infiammazione. RBioscience Institute offre un sistema integrato di rilevazione ed eliminazione selettiva degli eccessi di citochine nel sangue di persone sane in cui non sono presenti sintomi di patologie croniche o alterazioni genetiche prodromiche allo sviluppo del cancro, ma in cui è possibile identificare o prevenire condizioni fisiologiche o pre-patologiche che predispongono alla comparsa di queste alterazioni e di questi sintomi.

Attraverso il monitoraggio periodico dei livelli di citochine nel sangue è possibile rilevare l'aumento di uno o più mediatori dell'infiammazione e rimuoverli attraverso un sistema extracorporeo per la purificazione del sangue. I livelli di citochine vengono nuovamente misurati dopo la reinfusione del sangue purificato, e il ciclo operativo viene ripetuto fino a che i valori misurati non scendono al di sotto della soglia di attenzione.
Il prelievo di sangue e la rimozione delle citochine possono prevedere un unico processo continuo o avvenire separatamente. In questo secondo caso se i livelli di citochine rilevati dopo la reinfusione del sangue purificato sono ancora eccessivamente elevati si procede a un nuovo ciclo di prelievo e purificazione.
Dopo il completamento di un ciclo di eliminazione, la successiva analisi viene programmata in base dei livelli di citochine rilevati in partenza, della storia individuale e di altri fattori stabiliti dagli esperti del settore.