Con MICROBalance Bioscience Institute mette a disposizione una piattaforma per un’analisi del microbioma (il genoma del microbiota) mirata a identificare eventuali disequilibri al fine di correggerli attraverso strategie basate su un corretto stile di vita e, se necessario, l’assunzione di specifici integratori alimentari.

MICROBIOMA e MICROBIOTA
L’organismo non è un ambiente sterile: sia sulla sua superficie sia al suo interno è presente una grande varietà di microbi con cui convive pacificamente e che contribuiscono a determinare il suo stato di salute.
L’insieme di questi microbi (batteri, funghi, protozoi e virus) prende il nome di microbiota e comprende 100 trilioni (miliardi di miliardi) di batteri.
L’insieme del genoma di tutti questi microrganismi è invece detto microbioma.
Caratteristiche del microbiota intestinale
Il microbiota umano vive in diversi distretti corporei:
nel cavo orale, nello stomaco, nell’intestino tenue e nel colon; nell’orecchio; nel naso e nel polmone; nelle vie urinarie; nella vagina; e anche sulla pelle.
Quando si parla di microbiota intestinale si fa riferimento in particolare ai microbi che vivono nell’intestino, una comunità circa 10 volte più abbondante rispetto alle cellule umane del corpo e il cui genoma (il microbioma intestinale) contiene 100 volte più geni rispetto al genoma umano.
Questa comunità, nota anche come “flora intestinale”, si concentra soprattutto nel colon, dove in ogni grammo di contenuto intestinale si trovano ben 100 miliardi di batteri.

A cosa serve il microbiota
Il microbiota agisce come uno scudo contro i patogeni che potrebbero invadere pelle, cavo orale, tubo digerente e vagina. La sua robustezza influenza lo stato di salute, e si tratta di un elemento fondamentale per lo sviluppo del sistema immunitario e dell’immunotolleranza. Inoltre il microbiota gioca un ruolo fondamentale nella digestione e nell’assorbimento di alcuni componenti del cibo (fibre e minerali), nella sintesi di alcune vitamine e aminoacidi, nella produzione di sostanze che regolano le risposte immunitarie e metaboliche, nella detossificazione di sostanze potenzialmente nocive (inclusi cancerogeni) e nell’inattivazione di alcuni farmaci. In alcune situazioni, però, i patogeni possono prendere il sopravvento, proliferando fino a scatenare disturbi anche al di fuori dell’apparato digerente, come infezioni delle vie urinarie o vaginosi batteriche.
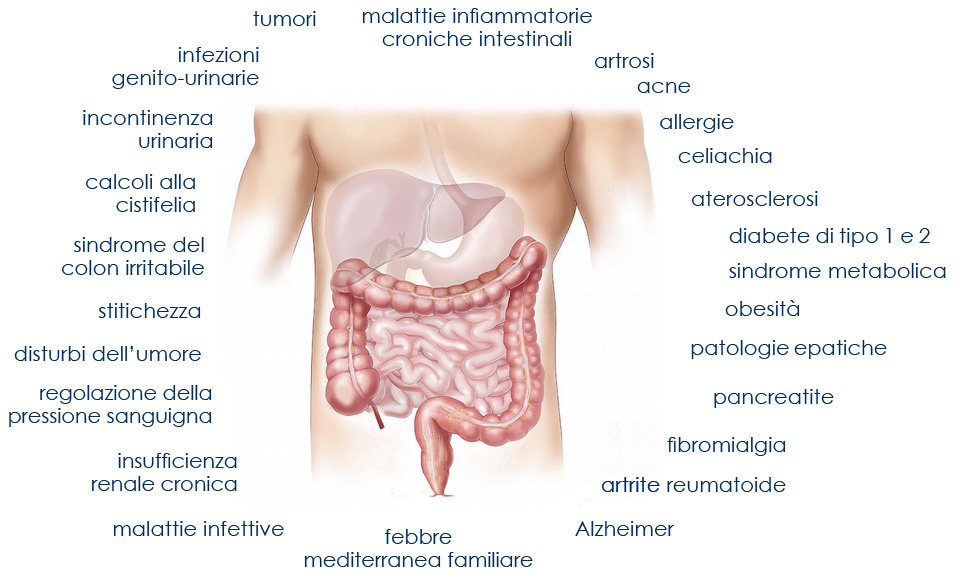
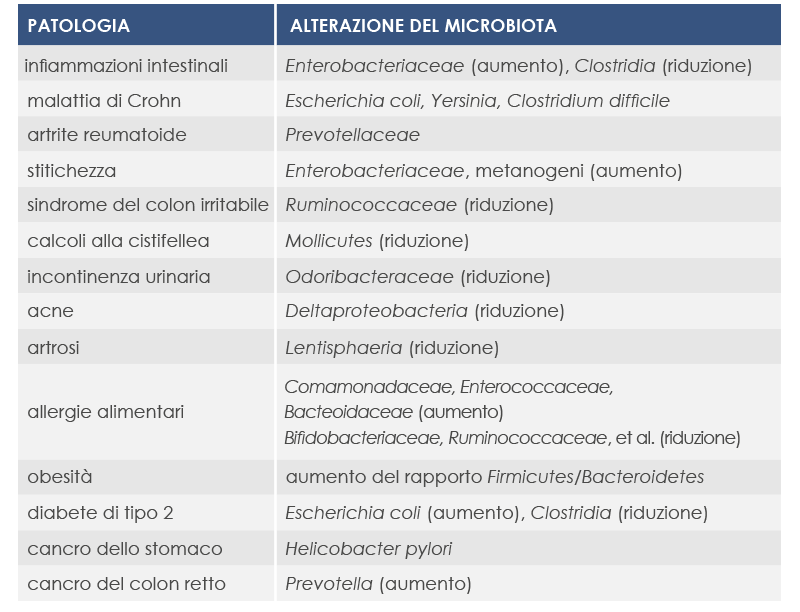
Queste e altre disbiosi (alterazioni del microbiota) caratterizzano sia le infiammazioni acute del tratto gastrointestinale sia altre condizioni associate all’infiammazione, incluso il cosiddetto inflammaging (l’infiammazione associata all’invecchiamento).
Microbiota vaginale e infezioni Genito-Urinarie
Le vie urinarie non sono sterili. Eventuali disbiosi del microbiota ad esse associato sono spesso caratterizzate da un aumento significativo di diversi ceppi di Escherichia coli (spesso portatori di resistenza multipla ai farmaci) di cui il microbiota intestinale rappresenta un vero e proprio serbatoio.
Nel caso delle donne entra in gioco anche il microbiota vaginale. Il primo passaggio della patogenesi delle infezioni delle vie urinarie è infatti la colonizzazione dell’introito vaginale e della zona circostante l’uretra, che è poi seguita dalla risalita del patogeno attraverso l’uretra fin nella vescica e, a volte, nei reni.

In altri casi, invece, il microbiota vaginale è di per sé un serbatoio di patogeni indipendente dal microbiota intestinale. In particolare, la perdita di specie di lattobacilli dotati di funzioni protettive aumenta sia il rischio di infezioni delle vie urinarie sia quello di vaginosi batteriche e infezioni da patogeni come Neisseria gonorrhoeae. Fra i fattori che possono alterare il microbiota vaginale sono inclusi l’esposizione ad antimicrobici e l’uso di alcuni spermicidi.
Approcci mirati a ridurre l’alterazione del microbiota intestinale e vaginale potrebbero ridurre il rischio di infezioni delle vie urinarie e di disturbi associati al microbiota vaginale.

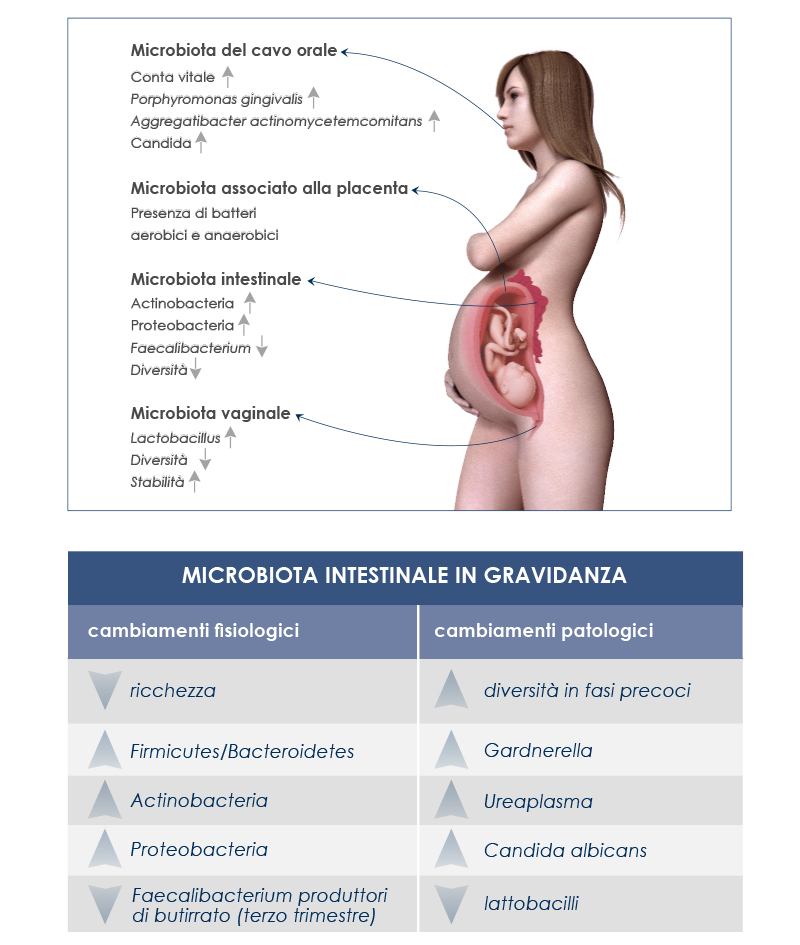
Microbiota intestinale e vaginale in gravidanza e allattamento
Il legame tra microbiota e salute inizia sin dalle primissime fasi della vita. Per questo è importante prendersi cura del benessere della flora batterica già durante la gravidanza e l’allattamento.
I cambiamenti endocrini, metabolici e immunitari tipici della gravidanza sono associati a significative variazioni del microbiota intestinale, ed è importante distinguere i cambiamenti salutari, necessari per il fisiologico aumento di peso materno e per nutrire il feto, da quelli indesiderabili che potrebbero essere associati a delle complicazioni o compromettere il buono sviluppo del microbiota intestinale del bambino.
È inoltre importante ricordare che in gravidanza variano anche il microbiota vaginale e quello orale.
Il microbiota vaginale aiuta a contrastare eventuali infezioni. Durante la gestazione la sua diversità diminuisce, mentre la sua stabilità aumenta; anche le specie di lattobacilli aumentano, mentre il pH diminuisce. Dopo il parto, invece, diventa più simile al microbiota intestinale, alcune specie di lattobacilli vengono gradualmente perse, la diversità aumenta e sono più presenti batteri associati alle vaginosi. Nel microbiota orale si osserva invece una maggiore prevalenza di patogeni associati alla parodontite e un aumento dei livelli di Candida.
La presenza di microbi intestinali nel liquido amniotico di donne che hanno avuto a che fare con una rottura
pretermine delle membrane suggerisce che il microbioma intestinale possa giocare un ruolo anche nelle infezioni intrauterine.
Ma c’è anche un altro buon motivo per garantirsi un microbiota in salute durante la gravidanza: l’intestino dei bambini nati per via vaginale viene prima di tutto colonizzato dai batteri presenti nella vagina e nell’intestino della madre.
È stato ipotizzato che l’assenza di tale trasmissione in caso di parto cesareo possa avere conseguenze a lungo termine sulla salute del bambino, come lo sviluppo di obesità, asma e celiachia. Inoltre i Bacteroides, più abbondanti dopo un parto per via vaginale, influenzano la maturazione del sistema immunitario.
Anche l’allattamento è fondamentale per lo sviluppo del microbiota intestinale del bambino. Durante il primo anno di vita la composizione microbica del latte materno cambia e, dato che i microbi presenti nel latte materno provengono dall’intestino, anche durante l’allattamento al seno è cruciale curare il microbiota intestinale materno.

Microbiota intestinale e sistema immunitario
Il microbiota intestinale gioca un ruolo fondamentale nell’induzione, nell’educazione e nel funzionamento del sistema immunitario. Il rapporto tra microbi e difese immunitarie inizia a svilupparsi durante l’allattamento e continuerà per tutta la vita a rinforzare quell’insieme di meccanismi che minimizzano il contatto tra i microrganismi e le cellule dell’epitelio intestinale (la cosiddetta immunità di barriera).
La presenza di una flora batterica adeguata garantisce il buon funzionamento delle difese immunitarie sia in condizioni fisiologiche sia in presenza di patologie infiammatorie, e protegge i tessuti dai danni che potrebbero derivare dall’infiammazione generata dalle cellule coinvolte nel controllo dei patogeni.
Un microbiota dotato di caratteristiche favorevoli (come una maggiore diversità) è associato alla riduzione del rischio di patologie come asma e allergie. Le disbiosi intestinali, invece, possono essere associate proprio ad asma, allergie ed eczemi.

Eventuali alterazioni del microbiota intestinale possono influenzare le risposte immunitarie sia a livello locale sia in organi distanti dall’intestino. La riduzione dei batteri “buoni” associata ai trattamenti antibiotici può per esempio ridurre la risposta all’infezione da parte del virus dell’influenza a livello dei tessuti del naso.
Questo controllo del microbiota intestinale sull’immunità sistemica ha profonde conseguenze anche su eventuali terapie. Per esempio, l’effetto sul microbioma dei trattamenti con radiazioni previsti da alcuni protocolli di immunoterapia favorisce la buona riuscita dei trapianti di midollo osseo; viceversa, l’alterazione del microbiota intestinale indotta dai trattamenti antibiotici può compromettere la risposta all’immunoterapia.

Microbiota intestinale, umore e comportamento
Così come la mente può influenzare il funzionamento dell’intestino, anche il microbiota intestinale influenza umore e comportamento.
Ad entrare in gioco sono segnali immunitari diretti dall’intestino verso il cervello, l’interazione del microbiota con la parete dell’intestino e il suo contatto con le terminazioni nervose di cui è ricco.
Modificando le risposte infiammatorie, le disbiosi promuovono uno stato di infiammazione cronica che può essere associato ad alterazioni dell’umore e del comportamento, a una maggiore reattività allo stress e a un’incidenza più elevata di disturbi stress-associati.
Anche i comportamenti alimentari possono essere influenzati dal microbiota.
I costanti stimoli nervosi e chimici provenienti dall’intestino vengono infatti rielaborati dal stistema nervoso centrale per produrre segnali in grado di regolare l’appetito e l’assunzione di cibo.
Microbiota intestinale e obesità
Anche l’obesità e le patologie ad essa associate vanno di pari passo con cambiamenti nel microbiota intestinale.
Questo legame dipende almeno in parte dal fatto che il microbiota intestinale partecipa alla regolazione delle energie assunte con l’alimentazione fermentando le fibre alimentari.
La conseguente produzione di acidi grassi a catena corta promuove la lipogenesi, l’accumulo dei trigliceridi e il differenziamento degli adipociti, mentre inibisce la lipolisi.
Inoltre l’aumento della capacità di digerire i carboidrati complessi farebbe aumentare l’energia estratta dagli alimenti.
Infine, il microbiota intestinale tipico delle persone obese riduce l’ossidazione degli acidi grassi e può riprogrammare l’espressione dei geni nel colon compromettendo il normale metabolismo dei trigliceridi e promuovendo l’accumulo di grassi.
Per quanto riguarda invece le complicanze dell’obesità, a entrare in gioco sono sia le variazioni nei livelli di alcuni batteri (come la riduzione di clostridi e l’aumento di lattobacilli associati alla resistenza all’insulina) e la riduzione della ricchezza del microbiota (associata sia all’insulino-resistenza sia alle dislipidemie), sia cambiamenti negli ormoni e in altre molecole prodotte dalle cellule endocrine dell’intestino, l’alterazione delle comunicazioni tra intestino e cervello e segnali diretti verso il tessuto adiposo. Infine, le disbiosi possono aumentare la permeabilità intestinale a prodotti di origine batterica come il lipopolisaccaride.

Microbiota e infiammazione
La perdita di batteri benefici riduce la capacità di regolare le risposte immunitarie, e la proliferazione eccessiva di batteri opportunisti caratterizzati da una spiccata invasività e da spiccate proprietà infiammatorie o in grado di proliferare proprio in presenza di metaboliti associati all’infiammazione può portare a un incremento dello stato infiammatorio.
Inoltre l’uso eccessivo di antibiotici, alcune abitudini alimentari e l’eradicazione di parassitosi croniche possono contribuire allo sviluppo dell’infiammazione favorendo la crescita di un microbiota privo della resilienza necessaria perché tra microbi intestinali e organismo si stabilisca un’interazione bilanciata che consenta lo sviluppo delle difese immunitarie senza che venga compromessa la tolleranza a sostanze innocue. Di conseguenza, alterazioni del microbiota possono essere associate a patologie caratterizzate da uno stato infiammatorio.
Le malattie infiammatorie croniche intestinali, per esempio, possono essere causate o esacerbate da mutazioni che alterando le risposte immunitarie a livello intestinale promuovono la proliferazione eccessiva di batteri che favoriscono l’aumento dell’infiammazione. Ma non solo: particolari caratteristiche del microbiota possono contribuire allo stato di infiammazione cronica associato all’aumento del rischio di sviluppo e progressione del cancro (per esempio allo stomaco, all’esofago o del colon retto, ma anche del seno) e possono essere associate all’inflammaging.
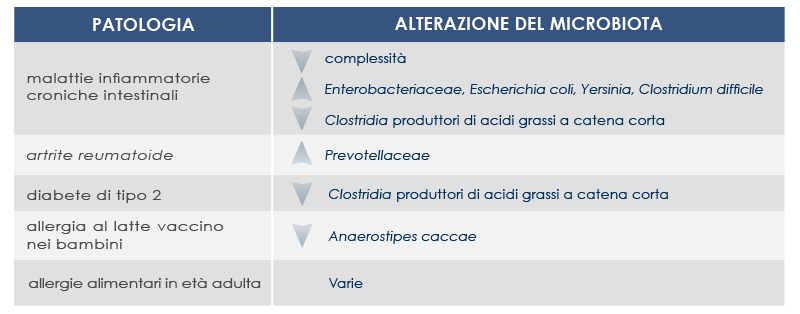
Microbiota intestinale e inflammaging
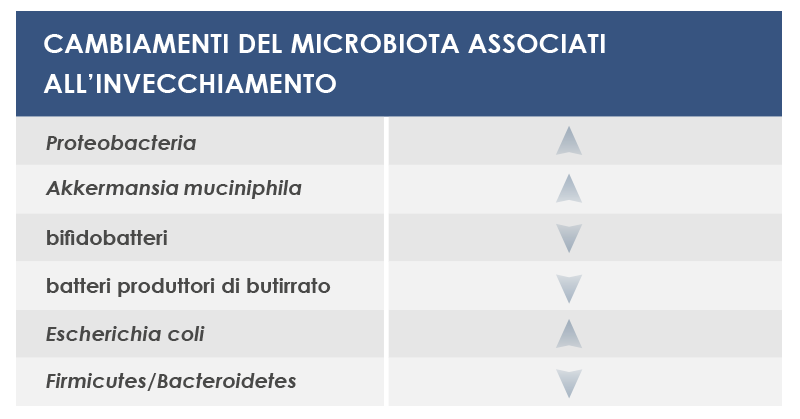
Il microbiota intestinale è coinvolto sia nell’induzione sia nel mantenimento dell’inflammaging.
A entrare in gioco sono cambiamenti associati alla maggior parte delle malattie tipiche dell’invecchiamento (degenerazione del sistema nervoso enterico, alterazioni della motilità intestinale e riduzione dell’efficienza della mucosa intestinale) a loro volta associati all’aumento delle citochine proinfiammatorie e a variazioni della composizione e della stabilità del microbiota intestinale.
In particolare, durante l’invecchiamento il microbiota tende a perdere la capacità di fermentare i carboidrati, a fermentare meglio le proteine e a essere caratterizzato da una minore diversità, con l’aumento di alcune specie rispetto ad altre. Alcuni cambiamenti risentono poco dell’influenza di fattori esterni, e potrebbero rappresentare le sue caratteristiche fondamentali nella terza età; altri dipendono invece dallo stile di vita, per esempio dall’alimentazione o dall’assunzione di farmaci.
Fra i batteri che possono variare sono inclusi: i Proteobacteria, che sono stati associati sia all’infiammazione locale sia all’infiammazione sistemica; Akkermansia muciniphila, che degrada uno dei componenti della barriera intestinale, la mucina; i bifidobatteri, fermenti lattici alleati della salute; i microbi che producono butirrato, regolatore dei mediatori dell’infiammazione; e l’Escherichia coli.
La presenza nel sangue di molecole derivanti dal microbiota intestinale può attivare i macrofagi verso uno stato proinfiammatorio che può promuovere l’aterosclerosi e che è associato non solo alle malattie cardiovascolari ma anche alla demenza vascolare. Inoltre le variazioni nei livelli di citochine e di acidi grassi a catena corta associati a cambiamenti nel microbiota intestinale possono influenzare il declino cognitivo. E la risposta proinfiammatoria stimolata dal lipopolisacaride (tossina batterica che può scatenare l’infiammazione sistemica) promuove la produzione di proteina beta-amiloide, fornendo la prova di un possibile legame tra il microbiota intestinale e la malattia di Alzheimer.


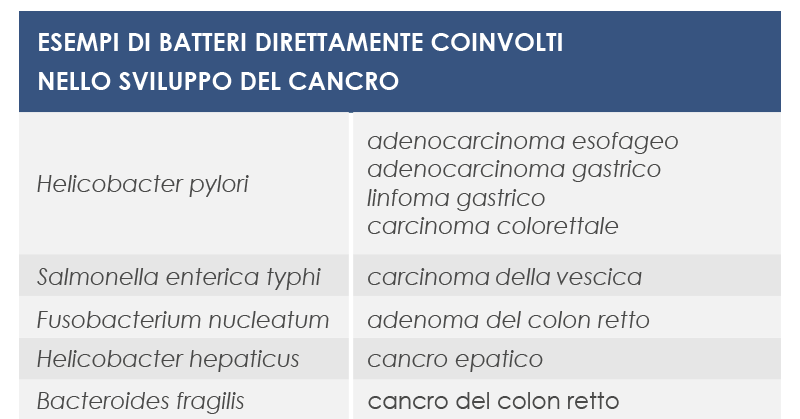
Microbiota e tumori
L’associazione tra microbiota, infiammazione e sistema immunitario influenza anche lo sviluppo dei tumori, sia a livello locale sia a livello sistemico.
Ad entrare in gioco possono essere sia le cellule dell’immunità innata sia quelle dell’immunità acquisita, meccanismi endocrini e vie nervose, la traslocazione di batteri, molecole di origine batterica o tossine e la modulazione dell’infiammazione sistemica e dello stress ossidativo.
Infine, il microbiota può dare un contributo importante anche nel determinare l’efficacia delle terapie antitumorali e i loro effetti collaterali. L’effetto della ciclofosfamide, per esempio, è modulato dalla flora commensale, e anche la risposta antitumorale dei trattamenti con oxaliplatino, cisplatino e oligonucleotidi CpG dipende dal microbiota intestinale.
Il microbiota di pazienti con melanoma che rispondono all’immunoterapia con anticorpi anti-PD1 è caratterizzato da maggiori diversità e abbondanza di Ruminococcaceae e Faecalibacterium, mentre specie di Bacteroides come B. thetaiotaomicron e B. fragilis contribuiscono a migliorare la risposta immunitaria contro il cancro indotta dagli anticorpi anti-CTLA-4. In altri casi i batteri commensali possono invece indurre effetti collaterali, come la diarrea che limita la dose di CPT-11 utilizzabile nei trattamenti.
A volte lo sviluppo del tumore dipende da una singola specie batterica in grado di alterare segnali e vie di comunicazione, per esempio producendo tossine che modulano l’infiammazione del microambiente tumorale, influenzano la stabilità genomica delle cellule dell’organismo o regolano i geni dell’ospite a livello epigenetico. Anche l’alimentazione può dare il suo contributo; alcuni batteri, per esempio, possono metabolizzare derivati della carne rossa producendo molecole potenzialmente pericolose per il DNA.
In altri casi entrano in gioco alterazioni come variazioni della composizione o della densità del microbiota. Inoltre esistono numerose prove dell’associazione tra l’obesità – noto fattore di rischio per il cancro – e il microbiota intestinale.
Non mancano però nemmeno batteri in grado di esercitare effetti protettivi contro il cancro, e alcuni prebiotici (sostanze che aumentano la crescita o l’attività del microbiota intestinale) possono contribuire alla prevenzione del cancro agendo come antiossidanti e riducendo l’infiammazione.
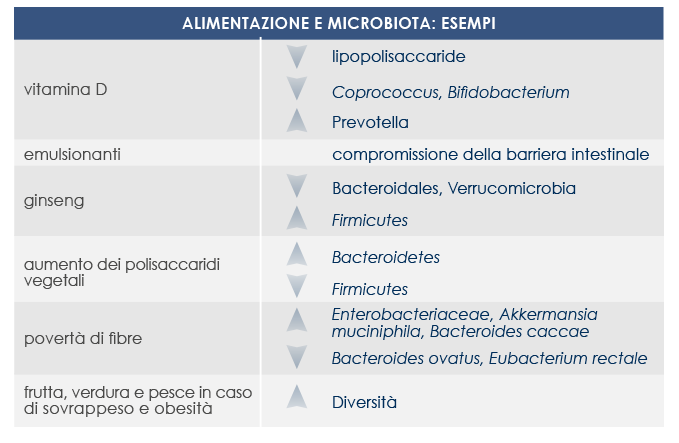
Microbiota intestinale e alimentazione
L’alimentazione è uno dei principali fattori in grado di modulare la struttura e la funzione del microbiota intestinale sin dalle primissime fasi della vita. Alcuni nutrienti (come i glicani, i chinoni e i flavonoidi) interagiscono direttamente con i batteri, promuovendo o inibendone la crescita. Inoltre alcuni composti di origine alimentare possono influenzare indirettamente il microbiota intestinale agendo sul metabolismo e sul sistema immunitario dell’ospite.
Per questo il microbiota risponde a cambiamenti nell’alimentazione e l’assunzione di prebiotici, probiotici e simbiotici è da tempo proposta come approccio per combattere i disturbi metabolici associati a un’alterazione della composizione del microbiota.
Benefici dei prebiotici
I prebiotici sono sostanze in grado di aumentare la crescita o l’attività dei batteri. I più noti sono le fibre non digeribili, presenti in molta frutta e verdura, ma le sostanze che possono agire come prebiotici sono anche altre, come i fitoestrogeni presenti in alcuni frutti di bosco.

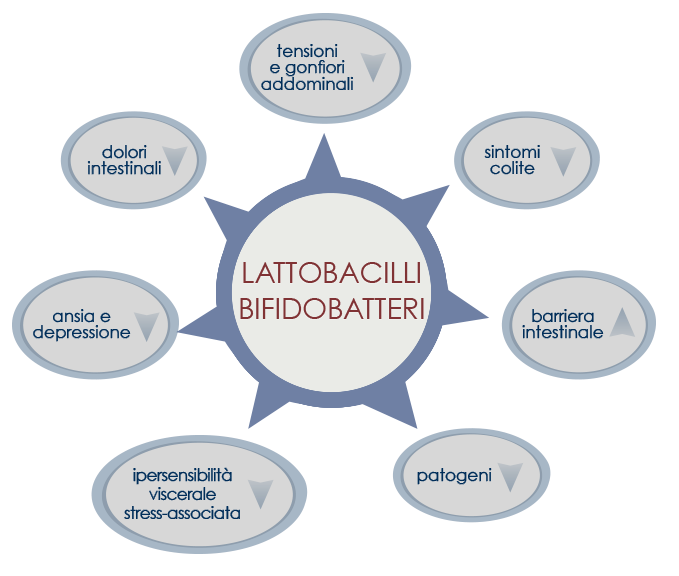
PROBIOTICI
I probiotici sono batteri vivi (lattobacilli e bifidobatteri) che possono apportare benefici alla salute quando vengono assunti per via orale, sotto forma di cibi fermentati o di integratori alimentari. Gli integratori alimentari a base di probiotici mirano a rifornire l’intestino di commensali associati a proprietà metaboliche favorevoli.
Le miscele di diversi ceppi sembrano essere più efficaci rispetto a preparazioni a base di singoli ceppi.
SIMBIOTICI
I simbiotici, infine, sono prodotti che combinano le proprietà dei prebiotici a quelle dei probiotici.
L’uso di diete su misura può promuovere cambiamenti nel microbiota intestinale nell’arco di una sola settimana.
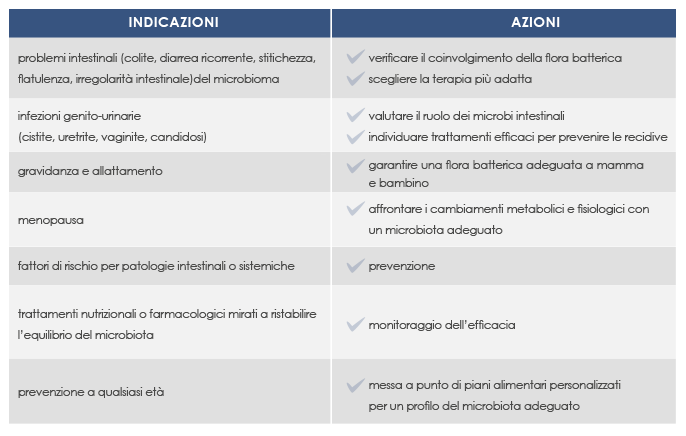
Indicazioni dell’analisi Microbalance
La composizione del microbiota di ogni individuo è unica, e alcuni profili sono stati associati a condizioni di salute migliori.
L’analisi del microbioma può aiutare a promuovere un buono stato di salute e a prevenire o affrontare patologie intestinali (per esempio coliti o diarree ricorrenti) o sistemiche (come l’obesità e la sindrome metabolica).
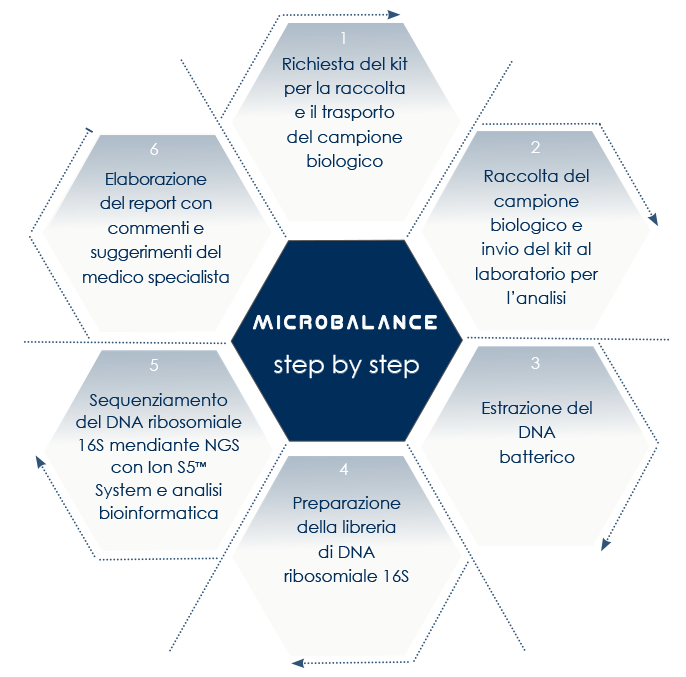
L’analisi del microbioma basata sulla moderna tecnologia del Next Generation Sequencing permette di studiare sia il microbioma intestinale sia il microbioma vaginale superando le difficoltà insite nella coltivazione dei microbi anaerobi in laboratorio.
Con MICROBALANCE Bioscience Institute permette di effettuare il prelievo del materiale necessario comodamente a casa.
Il profilo che si ottiene non rappresenta la diagnosi di una patologia ma permette, con la consulenza di medici e nutrizionisti qualificati, di mettere a punto un piano alimentare atto a correggere un eventuale disequilibrio nel microbiota e di valutare l’opportunità di ricorrere all’assunzione di specifici integratori alimentari.