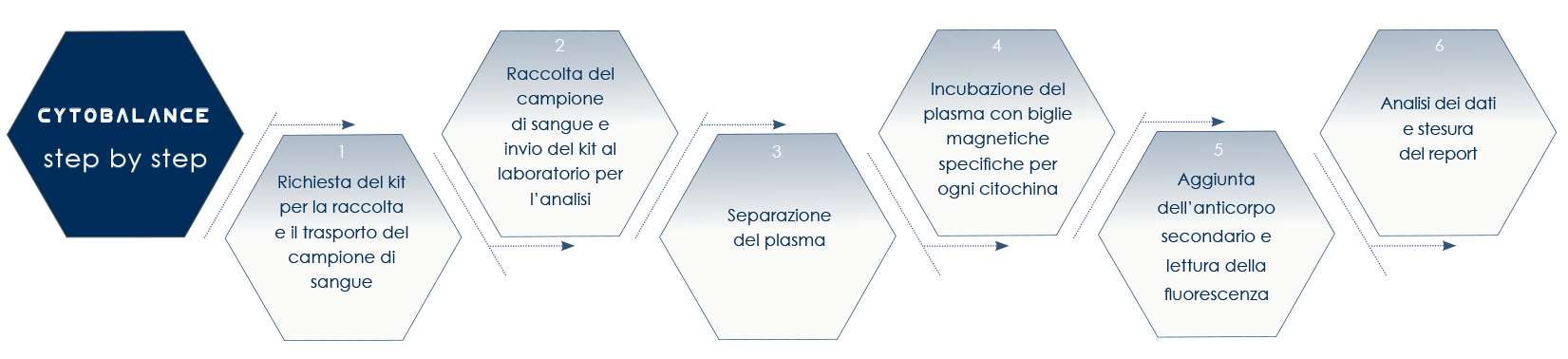
Con CYTOBALANCE, Bioscience Institute mette a disposizione un sistema di rilevazione degli eccessi di citochine nel sangue di persone sane in cui non sono presenti sintomi di patologie croniche o alterazioni genetiche prodromiche allo sviluppo del cancro, ma in cui è possibile identificare o prevenire condizioni fisiologiche o pre-patologiche che predispongono alla comparsa di queste alterazioni e di questi sintomi.
L’INFIAMMAZIONE CRONICA DI BASSO GRADO
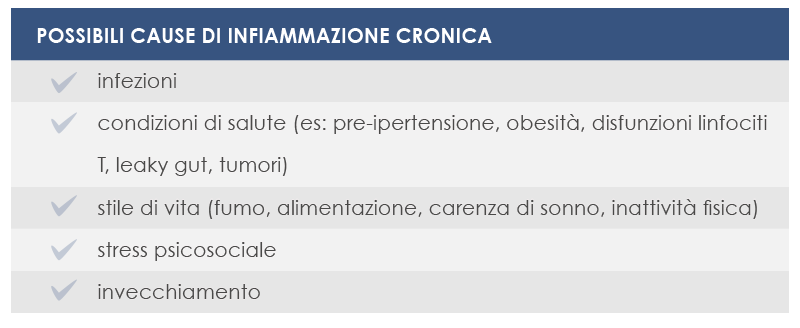
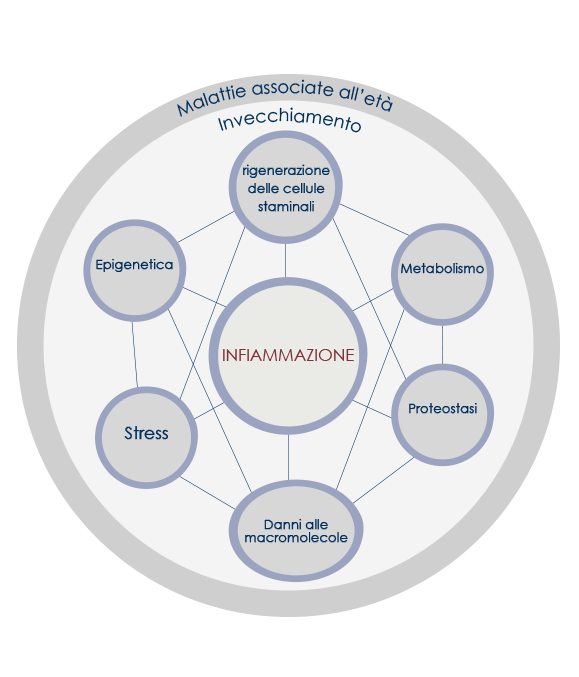
L’infiammazione è più di una risposta a un danno o a un’infezione: alla sua base possono esserci stimoli diversi dagli antigeni derivanti da virus e batteri. L’aumento dell’aspettativa di vita fa sì che il sistema immunitario debba far fronte a tutti questi stimoli per molto tempo, e che, di conseguenza, lo stato infiammatorio possa aumentare sensibilmente trasformandosi in quella che viene definita “infiammazione cronica di basso grado”. L’infiammazione cronica di basso grado è una delle principali cause della fragilità, della comparsa di patologie e dei decessi associati all’invecchiamento. Fra le malattie associate a questo fenomeno sono incluse l’aterosclerosi, l’Alzheimer, il Parkinson, il diabete di tipo 2 e anche forme tumorali. Contrastarlo può aiutare non solo a vivere a lungo ma anche a farlo nello stato di salute migliore possibile.
L’Inflammaging
L’infiammazione cronica di basso grado non associata a infezioni che si sviluppa durante l’invecchiamento prende il nome di inflammaging. A scatenarla sono soprattutto segnali endogeni (come la presenza di detriti cellulari o di proteine ossidate) che attivano il sistema immunitario in modo cronico. Anche l’eccesso di nutrienti e la superalimentazione possono dare il loro contributo, scatenando un tipo specifico di infiammazione cronica associato a disturbi metabolici come obesità e diabete di tipo 2, la cosiddetta “infiammazione metabolica” o “metaflammation”. Tutti gli stimoli che promuovo l’inflammaging convergono su un numero limitato di molecole che attivando l’immunità innata scatenano l’infiammazione e una risposta a livello metabolico. Fino alla mezza età questo processo è fondamentale per la sopravvivenza dell’organismo; spesso, però, l’invecchiamento è associato a un aumento della risposta infiammatoria che in età post-riproduttiva può risultare deleterio. Anche l’accumulo di cellule senescenti gioca un ruolo fondamentale. Per di più, con l’avanzare dell’età la capacità di risolvere l’infiammazione diminuisce e, secondo la cosiddetta teoria del garbaging, la progressiva compromissione della capacità di eliminare i detriti cellulari promuove, ancora una volta, l’inflammaging.

Infiammazione e endotossiemia metabolica
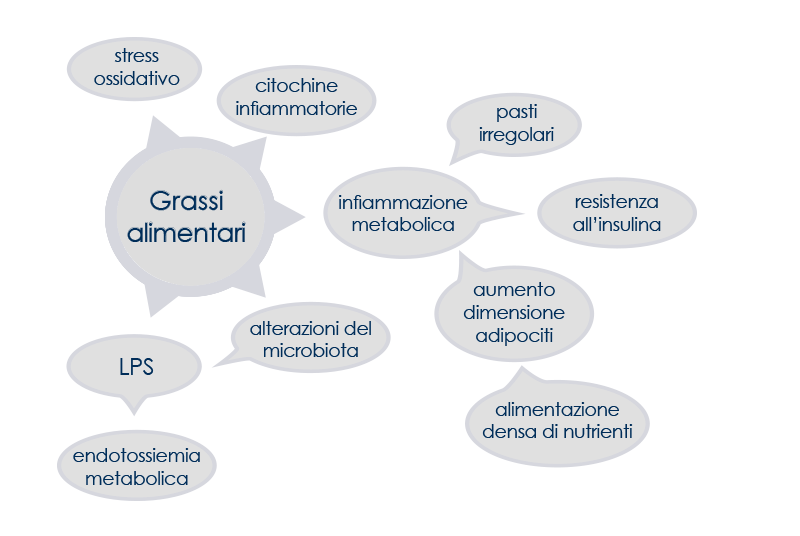
Il livello di infiammazione cronica aumenta progressivamente nell’arco di anni o decenni. Nel frattempo l’eccesso di nutrienti e la sovralimentazione promuovono l’inflammaging e l’infiammazione metabolica contribuisce alla comparsa della resistenza all’insulina, attivando risposte infiammatorie che colpiscono organi e tessuti come il cervello, i muscoli, il pancreas, il fegato e l’adipe.
A giocare un ruolo fondamentale sono i grassi di origine alimentare, associati all’aumento di stress ossidativo, citochine e livelli di lipopolisaccaride (LPS) – l’endotossina legata alla sepsi e all’endotossiemia metabolica, stato associato a infiammazione di basso grado e disturbi cardiometabolici. Anche i pasti irregolari possono contribuire alle alterazioni del metabolismo e delle risposte infiammatorie.
Un’alimentazione densa di nutrienti induce invece l’aumento delle dimensioni degli adipociti fino al raggiungimento di un punto critico in cui anche queste cellule contribuiscono all’infiammazione metabolica.
La riduzione delle funzioni immunitarie associata all’infiammazione cronica di basso grado e l’aumento delle citochine proinfiammatorie influenzano negativamente metabolismo, densità ossea, forza, resistenza all’esercizio, apparato vascolare, funzioni cognitive e umore. Per questo fra le patologie associate all’inflammaging sono incluse, fra le altre, il diabete, le malattie cardiovascolari, l’osteoporosi e la demenza.

Microbiota intestinale e inflammaging
Il microbiota intestinale è coinvolto sia nell’induzione sia nel mantenimento dell’inflammaging.
A entrare in gioco sono cambiamenti associati alla maggior parte delle malattie tipiche dell’invecchiamento (degenerazione del sistema nervoso enterico, alterazioni della motilità intestinale e riduzione dell’efficienza della mucosa intestinale) a loro volta associati all’aumento delle citochine proinfiammatorie e a variazioni della composizione e della stabilità del microbiota intestinale.
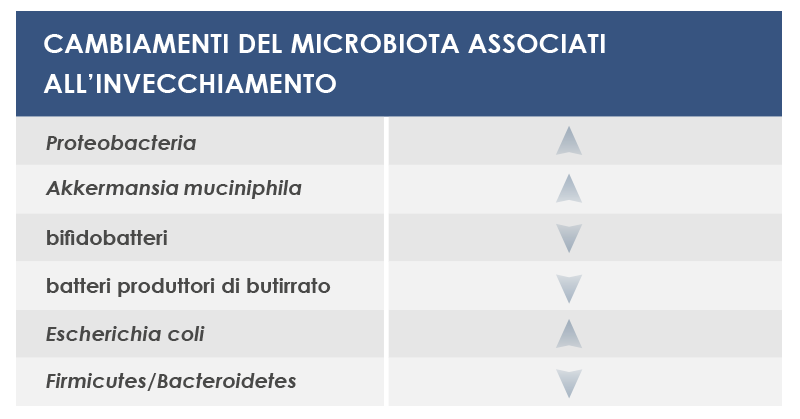
In particolare, durante l’invecchiamento il microbiota tende a perdere la capacità di fermentare i carboidrati, a fermentare meglio le proteine e a essere caratterizzato da una minore diversità, con l’aumento di alcune specie rispetto ad altre. Alcuni cambiamenti risentono poco dell’influenza di fattori esterni, e potrebbero rappresentare le sue caratteristiche fondamentali nella terza età; altri dipendono invece dallo stile di vita, per esempio dall’alimentazione o dall’assunzione di farmaci.
Fra i batteri che possono variare sono inclusi: i Proteobacteria, che sono stati associati sia all’infiammazione locale sia all’infiammazione sistemica; Akkermansia muciniphila, che degrada uno dei componenti della barriera intestinale, la mucina; i bifidobatteri, fermenti lattici alleati della salute; i microbi che producono butirrato, regolatore dei mediatori dell’infiammazione; e l’Escherichia coli.
La presenza nel sangue di molecole derivanti dal microbiota intestinale può attivare i macrofagi verso uno stato proinfiammatorio che può promuovere l’aterosclerosi e che è associato non solo alle malattie cardiovascolari ma anche alla demenza vascolare. Inoltre le variazioni nei livelli di citochine e di acidi grassi a catena corta associati a cambiamenti nel microbiota intestinale possono influenzare il declino cognitivo. E la risposta proinfiammatoria stimolata dal lipopolisacaride (tossina batterica che può scatenare l’infiammazione sistemica) promuove la produzione di proteina beta-amiloide, fornendo la prova di un possibile legame tra il microbiota intestinale e la malattia di Alzheimer.
Infiammazione e DNA mitocondriale
Anche la fuoriuscita di materiale genetico dai mitocondri (mtDNA) può scatenare l’infiammazione. Le sue cause principali sono stress cellulare e necrosi, ma diversi studi suggeriscono che possano entrare in gioco anche fenomeni come la necrosi programmata e il rilascio di mitocondri dalle piastrine. Inoltre i livelli di mtDNA aumentano gradualmente dopo i cinquant’anni, contribuendo all’inflammaging. La somiglianza del mtDNA a quello batterico e il suo stato di ossidazione stimolano la risposta immunitaria e promuovono l’infiammazione. L’azione infiammatoria del mtDNA è mediata dal Toll-Like Receptor 9 (TLR-9) e può coinvolgere l’inflammasoma e la via dei geni stimolatori dell’interferone (STimulator of INterferon Genes, STING).
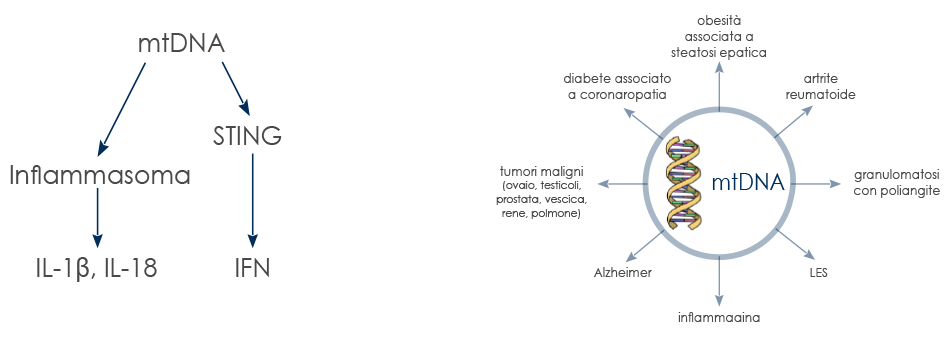
Livelli elevati di mtDNA nel sangue sono associati a malattie croniche organo-specifiche e sistemiche. L’ambiente extracellulare tipico delle malattie croniche, altamente ossidante, può sopraffare i sistemi antiossidanti, aumentando ulteriormente il suo potenziale infiammatorio.

Infiammazione cronica e tumori
Oltre il 20% delle neoplasie è indotto o aggravato da un processo infiammatorio:
il tumore dello stomaco è associato alla gastrite, il cancro del colon alla colite, il carcinoma epatocellulare all’infiammazione cronica, e quasi il 20% dei fumatori con bronchite può sviluppare un cancro. Viceversa, l’assunzione di Fans è associata a una riduzione del 30-60% dell’incidenza del cancro del colon. La correlazione fra infiammazione e tumori si esplica attraverso vie estrinseche (l’infiammazione crea condizioni che favoriscono l’accumulo di mutazioni) e vie intrinseche (eventi genetici come l’attivazione di oncogeni che stimolano processi infiammatori). Inoltre l’infiammazione cronica è associata all’immunosoppressione, noto fattore di rischio per lo sviluppo di tumori.
La sua azione è mediata dalla generazione di specie reattive dell’ossigeno (ROS) e dell’azoto (RSN), dall’alterazione della metilazione del DNA e da una serie di molecole prodotte dalle cellule dell’immunità. In particolare, ROS e RSN danneggiano DNA, proteine e lipidi, senza risparmiare nemmeno le cellule staminali e favorendo, così, lo sviluppo di forme tumorali particolarmente aggressive e l’instaurarsi di un circolo vizioso di infiammazione e stress ossidativo che gioca un ruolo cruciale nello sviluppo dei tumori.
Inoltre ROS e RSN possono indurre una demetilazione generalizzata del DNA, promuovendo un altro fenomeno associato allo sviluppo del cancro: l’instabilità genomica. Allo stesso tempo, le citochine proinfiammatorie possono aumentare la metilazione riducendo l’espressione di geni e microRNA oncosoppressori.
Gli effetti finali includono la promozione della crescita e della sopravvivenza delle cellule tumorali, l’angiogenesi, l’invasione dei tessuti e la formazione di metastasi, oppure la soppressione delle risposte immunitarie antitumorali.
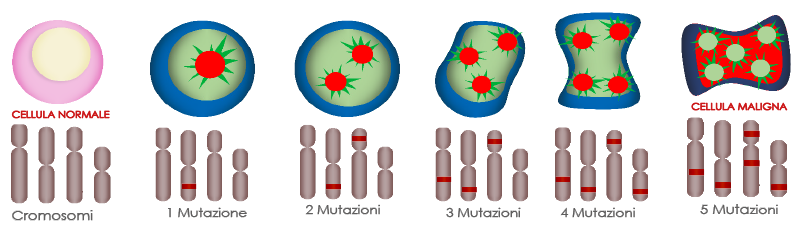
la progressione delle mutazioni nello sviluppo di una cellula tumorale
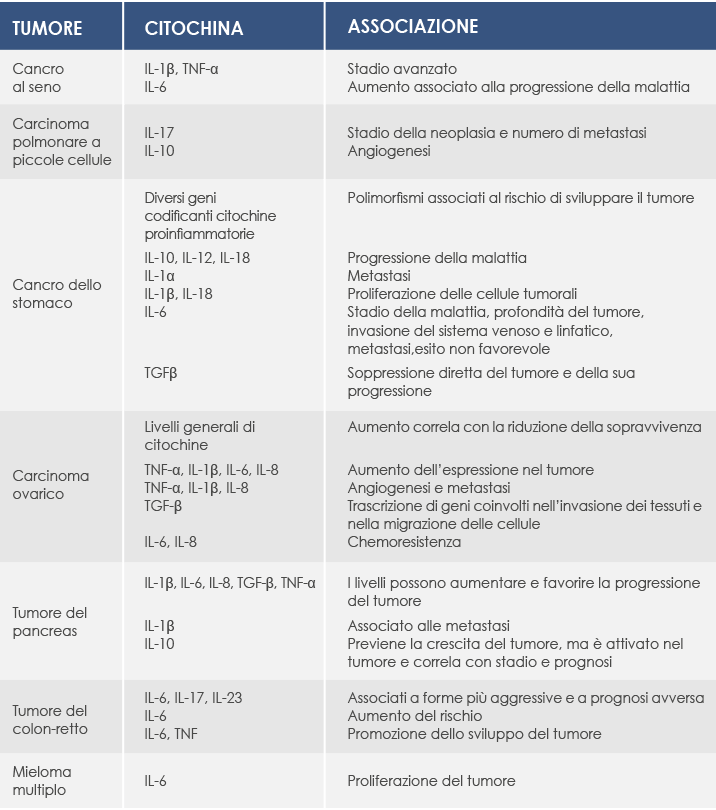
I marcatori dell'infiammazione nei tumori
Diversi marcatori biomolecolari dell’infiammazione sono associati anche ai tumori. Le citochine proinfiammatorie vengono prodotte sia dalle cellule tumorali sia dalle cellule presenti nell’ambiente circostante la massa tumorale, come i Tumor-Associated Macrophages produttori di Tumor Necrosis Factor α (TNF-α), una citochina sintetizzata nella fase iniziale della risposta infiammatoria che gioca un ruolo fondamentale nel mantenimento dell’infiammazione cronica ed è coinvolta nella crescita dei tumori, nell’angiogenesi, nel rimodellamento dei tessuti e nella formazione delle metastasi.

Le citochine proinfiammatorie regolano anche la produzione di proteina C reattiva (PCR). I suoi livelli sono molto bassi nelle persone sane, ma aumentano rapidamente con l’infiammazione e sono associati alla progressione del tumore e alla riduzione della sopravvivenza in presenza di diverse neoplasie (esofago, stomaco, colon retto, fegato, pancreas, ovaio).
Concentrazioni di PCR più elevate sono associate a un maggior rischio di sviluppare un cancro (per esempio del colon retto e al seno) e correlano con la mortalità per tumore del colon retto.
Come riconoscere l'infiammazione cronica
L’infiammazione cronica di basso grado non è associata dai classici sintomi dell’infiammazione acuta (gonfiore, dolore, arrossamento e calore), ma numerosi marcatori biomolecolari (tra cui diverse citochine e la PCR) permettono di riconoscere la sua presenza grazie ad una semplice analisi del sangue. Con CYTOBALANCE Bioscience Institute propone il monitoraggio di 13 diversi marcatori dell’infiammazione.

GM-CSF - Il Granulocyte-Macrophage Colony-Stimulating Factor è un fattore che stimola la crescita dei precursori di diverse cellule del sangue, tra cui granulociti e macrofagi.
TNF-α - Basse dosi di Tumor Necrosis Factor α aumentano l’espressione di molecole di adesione sulla superficie delle cellule endoteliali vascolari, facendo così stravasare i leucociti dal sangue nel sito di infezione. Inoltre il TNF-α attiva i leucociti stravasati e stimola i fagociti mononucleati a produrre chemochine che contribuiscono al reclutamento linfocitario. Nel tumore contribuisce all’immunosoppressione e favorisce la crescita tumore e la transizione epitelio-mesenchimale.
IL-2 - L’interleuchina 2 è il principale mediatore capace di stimolare il passaggio dalla fase G1alla fase S del ciclo cellulare dei linfociti T. È un fattore di crescita autocrino per i linfociti T, stimola la sintesi di altre citochine e promuove la crescita delle cellule NK, potenziandone l’azione citotossica.
IL-4 - L’interleuchina 4 modula la risposta immunitaria agendo su vari tipi cellulari, come linfociti T e B, macrofagi e cellule endoteliali. Tra le sue azioni sono incluse l’induzione della crescita e differenziazione delle cellule Th2, l’incremento dell’espressione degli antigeni MHC di classe II sulle cellule B e il richiamo di cellule della flogosi attraverso la modulazione dell’espressione di molecole di adesione (V-CAM-1) sulle cellule endoteliali dei vasi.
IL-5 - L’interleuchina 5 induce la differenziazione degli eosinofili e l’aumento della produzione di IgA. Inoltre contribuisce a stimolare la crescita delle cellule B.
IL-6 - L’interleuchina 6 è l’attivatore principale della differenziazione dei linfociti in plasmacellule e cellule produttrici di IgA. Inoltre induce il ciclo cellulare nei progenitori emopoietici, megacariocitopoietici e mielopoietici, e stimola gli epatociti a produrre proteine della fase acuta. Livelli elevati di IL-6 possono aumentare la suscettibilità a diversi tipi di tumore, come il carcinoma epatocellulare, il mieloma multiplo e il tumore del polmone.
IL-9 - L’interleuchina 9 induce lo sviluppo dei linfociti T helper.
IL-10 - L’interleuchina 10 contiene ed eventualmente fa terminare le reazioni infiammatorie, contribuendo a facilitare l’eliminazione dei patogeni per limitare i danni dell’infezione. A
seconda della durata, del livello e della localizzazione della sua espressione può indurre
effetti differenti: in alcune condizioni si osserva l’atteso effetto immunosoppressivo, in altre un’amplificazione della risposta immunitaria e infiammatoria.
IL-12 - L’interleuchina 12 rappresenta un importante collegamento tra immunità innata e specifica: si tratta del principale mediatore delle fasi precoci delle risposte immunitarie innate e cellulo-mediate ai microrganismi intracellulari.
IL-17A - L’interleuchina 17A induce la produzione del Granulocyte Colony-Stimulating Factor (G-CSF) e di chemochine come CXCL1. Gioca un ruolo importante nell’infiammazione cronica associata alla patogenesi delle malattie autoimmuni e delle allergie, e si ritiene che svolga un ruolo chiave nello sviluppo della psoriasi. Recenti studi hanno inoltre dimostrato che la concentrazione di IL-17A aumenta nel siero di soggetti affetti da tumore, e che possa quindi avere un valore prognostico significativo.
INF-α - L’interferone α interviene nella risposta immunitaria innata verso patogeni di origine virale. Sintomi come febbre e debolezza muscolare sono in parte dovuti alla presenza di interferone.
IFN-γ - L’interferone γ è la principale citochina per l’attivazione dei macrofagi e svolge importanti funzioni sia nell’immunità innata sia nelle risposte cellulo-mediate specifiche contro i microrganismi intracellulari. Attiva le cellule effettrici della risposta immunitaria e stimola i macrofagi a uccidere i microrganismi fagocitati.
PCR - In presenza di processi infiammatori i livelli di proteina C reattiva si moltiplicano anche di mille volte, e in presenza di gravi danni ai tessuti (inclusi quelli che possono essere indotti dalla progressione di un tumore) passano da circa 1 μg/ml a oltre 500 μg/ml nell’arco di sole 24-72 ore. Gioca un ruolo attivo nei processi infiammatori e le sue concentrazioni sono da tempo utilizzate come marcatore delle infezioni e di eventi cardiovascolari in individui altrimenti asintomatici. Inoltre sono state associate alla prognosi in caso di aterosclerosi, scompenso cardiaco congestizio, fibrillazione atriale, miocardite, problemi alla valvola aortica e trapianto cardiaco. Infine, l’espressione della PCR è elevata anche in presenza di altri disturbi associati all’infiammazione, per esempio l’artrite reumatoide.